|
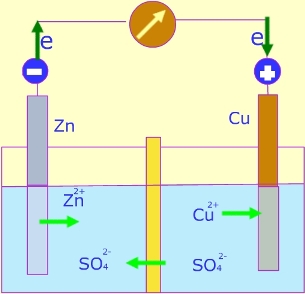
En este apartado describimos las reacciones de transferencia de electrones desde un punto de vista más técnico. Es importante que lo leas detenidamente para comprender lo que está ocurriendo en las experiencias. Si introducimos un trozo de cinc en una disolución de sulfato de cobre (CuSO4), el cinc reacciona espontáneamente disolviéndose y generando iones Zn2+, que sustituyen a los iones Cu2+ en la disolución, trasformándose éste en cobre metálico. Se está produciendo una reacción de transferencia de electrones: cada átomo de cinc cede dos electrones a un ion Cu2+. Se está produciendo una reacción de transferencia de electrones, que podemos representar de la siguiente forma: Se dice entonces que el cinc se está oxidando (pierde electrones) y el cobre se está reduciendo (gana electrones). De ahí el nombre que reciben estas reacciones de transferencia de electrones: reacciones de óxido-reducción o reacciones redox. Si esos electrones que son trasferidos entre esos metales los hacemos pasar por un circuito externo, habremos conseguido trasformar la energía química en energía eléctrica. Precisamente en este principio de basa la Pila Daniell: Consta de dos compartimentos, como podemos observar en la figura; uno de ellos contiene una disolución diluida de una sal de cinc (sulfato de cinc) en la que se introduce una lámina de cinc metálico, y el otro compartimento contiene una disolución saturada de una sal de cobre (sulfato de cobre (II)), en la que está inmersa una lámina de cobre. A cada una de estas láminas de metal se le llama electrodos (uno de ellos se llama ánodo, en este caso el electrodo de zinc donde se produce la oxidación, y otro cátodo, el electrodo de cobre, donde se produce la reducción). Separando las dos disoluciones tenemos un tabique poroso o un puente salino cuya finalidad es que no cese el flujo de cargas a medida que se fueran acumulando las cargas positivas en el compartimento de cinc y las negativas en el de cobre:
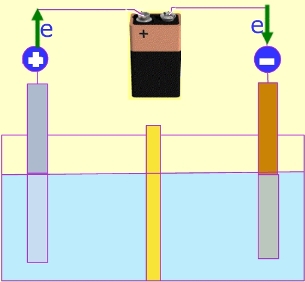
¡Hemos encontrado una fuente de energía eléctrica a partir de reacciones químicas! Electrolisis.¿Qué ocurriría si realizáramos el proceso inverso?. La electrólisis es precisamente el proceso que fuerza la reacción inversa mediante el aporte de energía externa. Cuando hacemos circular una corriente por una disolución o a través de sales fundidas, se provocan cambios químicos importantes.
Si por ejemplo disolvemos cloruro de sodio fundido, esta sustancia se encontrará disuelta en iones positivos (sodio) e iones negativos (cloro), de forma que al conectarle una fuente de alimentación se producirá una corriente eléctrica a través de la disolución. Los iones Na+ tomarán electrones y se depositará en forma de sodio metálico, mientras que los iones de cloro cederán sus electrones formándose cloro gaseoso. La reacción que se está produciendo será:
Electrolisis del agua.Si en un recipiente que contiene agua con una sal disuelta se introducen dos electrodos conectados a una fuente de corriente continua, se producirá la trasformación del agua en hidrógeno y en oxígeno. Lo explicamos con más detalle en el apartado de experiencias. |