|
Pregunta 1
|
Dados
cuatro elementos de números atómicos 9, 12, 15 y 24:
a) Determina
sus configuraciones electrónicas.
b)
Explica la valencia que los elementos de Z = 9
y Z = 12 tienen frente al hidrógeno.
c)
Explica las valencias que el elemento Z = 15 tiene
frente al oxígeno.
d)
Razona la valencia 6 que el elemento de Z = 24
tiene frente al oxígeno.
|
|
| Respuesta
1
|
a)
Las configuraciones electrónicas de los elementos que se
proponen son, referidas a la del gas noble anterior:
ZA = 9; A = [He] 2s2 2p5
ZB = 12; B = [Ne] 3s2
ZC = 15; C = [Ne] 3s2 3p3
ZD = 24; D = [Ar] 4s2 3d4
donde cuando indicamos, por ejemplo, [Ar] nos referimos a
la configuración electrónica de esa especie, es decir,
1s2 2s2 2p6 3s2 3p6.
Con estos datos, podemos identificar esos elementos: A se corresponde
con el flúor, F; B es el magnesio, Mg; C es el fósforo,
P; y el D corresponde al cromo, Cr.
b) Frente al hidrógeno, el elemento A presentará
una valencia 1, pues la tendencia del elemento A será completar
su estructura electrónica, captando el electrón del
hidrógeno. Por tanto dará lugar a un compuesto de
fórmula HA, o, lo que es lo mismo, HF.
Del mismo modo, el elemento B presentará una valencia 2 frente
al hidrógeno, pues tenderá a cederle esos dos electrones
(con la consiguiente formación de un hidruro) para estabilizar
su estructura electrónica, que, de ese modo, quedará
isoelectrónica a la del gas noble neón. Esto es así
porque, en este caso, es más electronegativo el H que la
especie B (metálica).
En cualquier caso, la fórmula del compuesto formado será
BH2, es decir, MgH2, pues se precisarán
dos átomos de hidrógeno para aceptar, respectivamente,
cada uno de esos dos electrones que el Mg debe ceder.
c) Frente al oxígeno, el elemento C deberá
ceder electrones, pues el oxígeno es un elemento más
electronegativo, y tenderá a completar sus niveles electrónicos
aceptando dos electrones de ese elemento. Por tanto, para la especie
C, las posibilidades más lógicas son:
 Ceder
tres electrones, valencia 3, dando lugar al C2O3,
es decir, P2O3. Ceder
tres electrones, valencia 3, dando lugar al C2O3,
es decir, P2O3.
 Ceder cinco electrones, valencia 5, formando el C2O5,
es decir, P2O5.
Ceder cinco electrones, valencia 5, formando el C2O5,
es decir, P2O5.
d) La valencia 6 del elemento D puede
justificarse porque, de ese modo, adquiere la configuración
de gas noble, es decir, la del argón (pues se desprende de
los electrones que ocupan los orbitales 4s y 3d). De ahí
que la pérdida de esos 6 electrones sea debida a la acción
de tres átomos de oxígeno (que de ese modo también
adquieren la estructura estable de gas noble) y en consecuencia,
el compuesto resulta ser DO3, o, lo que es lo mismo,
CrO3. |
|
|
Pregunta 2
|
| Disponemos
de los elementos A, B, C y D, cuyos números atómicos
son, respectivamente, 9, 11, 17 y 20.
a)
Escribe la configuración electrónica de
los mismos e indica la familia del Sistema Periódico a
la que pertenecen.
b) Indica el tipo de enlace que se produciría
en las uniones A A y C D, justificando cada una de las
respuestas.
|
|
| Respuesta
2 |
a)
Las configuraciones electrónicas de los elementos que se
proponen son, referidas a la del gas noble anterior:
ZA = 9; A = [He] 2s2 2p5
ZB = 11; B = [Ne] 3s1
ZC = 17; C = [Ne] 3s2 3p5
ZD = 20; D = [Ar] 4s2
Donde, cuando indicamos, por ejemplo, [Ar] nos referimos a la configuración
electrónica de esa especie, es decir, 1s2 2s2
2p6 3s2 3p6.
Con estos datos, podemos llegar a identificar también esos
elementos:
A se corresponde con el primer elemento del grupo 17, pues
en esa configuración sólo falta un electrón
para completar la estructura equivalente a la de los gases nobles.
Es la familia de los halógenos, y el elemento A es, por tanto,
el flúor, F.
B se encuentra en el primer grupo del Sistema Periódico,
en la familia de los alcalinos, y en el tercer período (lo
indica el último orbital que se ha ocupado, el 3s). Corresponde,
por tanto, esa estructura electrónica al sodio, Na.
C vuelve a estar en el grupo 17 de los halógenos (presenta
la misma configuración electrónica externa que A),
en el período siguiente al del flúor. Es, por tanto,
el segundo elemento de la familia: el cloro, Cl.
D se encuentra en el grupo 2 del Sistema Periódico,
pues son dos los electrones que ocupan su última capa electrónica
en un orbital s. Es la familia de los llamados alcalinotérreos.
Además, podemos deducir que pertenece al cuarto período
(el orbital más externo ocupado es el 4s). Se tratará,
por tanto, del calcio, Ca.
b)
El tipo de unión A A debe ser, necesariamente, de carácter
covalente, pues se trata de un no metal unido consigo mismo. Si
recurrimos a los diagramas de Lewis, podemos explicar la estructura
de esa molécula: A tiene como configuración electrónica
[He] 2s2 2p5. Vemos que está a falta
de captar un electrón para lograr completarla y hacerse
isoelectrónica con la de los gases nobles. Cuando esté
obligado a enlazarse, pondrá en juego uno de esos siete
electrones de su última capa para compartir con otro, en
este caso de su misma naturaleza. Con ello tendremos una especie
molecular donde cada átomo de A mantiene tres pares de
electrones sin compartir, y ha establecido entre ambos, un enlace
covalente sencillo, compartiendo entre ambos un par de electrones.
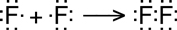
Luego la
fórmula sería A2, que particularizada
en el elemento ya identificado, resulta F2.
Sin embargo,
el tipo de unión C D será de tipo iónico.
Esto se debe a que están enfrentándose dos átomos
de muy diferente electronegatividad, el C, que sólo necesita
un electrón para completar su última capa, y el D,
que precisa prescindir de dos electrones para alcanzar la configuración
del gas noble que le precede, el Ar.
En tales
condiciones, dos átomos de C podrán captar, cada
uno, un electrón de un mismo átomo de D, con lo
que ambos se habrán transformado respectivamente en las
especies iónicas:
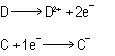
quedando
con las configuraciones electrónicas respectivas (que además
son isoelectrónicas):
D2+
= [Ne] 3s2 3p6 = [Ar]
C
= [Ne] 3s2 3p6 = [Ar]
y entre iones
de esas características se producirán las atracciones
eléctricas que los fijaran en sus posiciones dentro de
un cristal iónico, cuya fórmula (que sólo
expresará la proporción entre iones de uno y de
otro signo) será, para mantener la neutralidad de cargas
en el compuesto: DC2, o, lo que es lo mismo, referidos
a las especies que ya hemos identificado, CaCl2 (cloruro
de calcio).
|
|
| Respuesta
3 |
Para
establecer los diagramas de Lewis de esas moléculas, precisamos
conocer la posición en el Sistema Periódico de sus
elementos (pues en función de ella ya puede saberse el número
de enlaces covalentes que establece cada átomo no metálico,
y el número de pares de electrones sin compartir que retiene),
o sus números atómicos, que proporcionan la misma
información analizando la configuración electrónica
más externa.
Según esto último, tendríamos:
ZO = 8; 1s2 2s2
2p4
ZC = 6; 1s2 2s2
2p2
Vemos que cada átomo de O tiene en su última
capa 6 electrones (que remarcamos en negrita), por lo que siempre
pondrá dos en juego a compartir con otros dos de otro/os
átomo/os (formación de dos enlaces covalentes), permaneciendo
los otros 4 electrones sin compartir.
Del mismo modo, cada átomo de C tiene 4 electrones en su
última capa (también remarcados), y deberá
ponerlos todos en juego para compartir con otros átomos (no
tendrá, por tanto, ningún electrón sin compartir),
formando siempre 4 enlaces covalentes.
Entonces, según esto, las estructuras de
Lewis que se piden son:
C2H2:
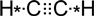
o bien:
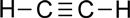
H2O:
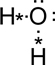
o bien:
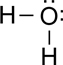
CO2:
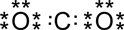
o bien:
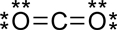
|
|
|
|
| Respuesta
4
|
Las
estructuras electrónicas que se piden son:
Z = 11; 1s2 2s2 2p6 3s1
Þ
Na
Z = 12; 1s2 2s2 2p6 3s2
Þ
Mg
Z = 13; 1s2 2s2 2p6 3s2
3p1 Þ
Al
Z = 15; 1s2 2s2 2p6 3s2
3p3 Þ
P
y conociendo el Sistema Periódico, y el lugar donde se ubicaran,
podemos saber que corresponden a los elementos que indicamos a continuación
de las configuraciones electrónicas.
Para saber el tipo de enlace que establecerán con el elemento
de Z = 17, analizaremos la configuración electrónica
de este elemento:
Z = 17; 1s2 2s2 2p6 3s2
3p5 ÞCl
Aunque no hubiésemos tenido presente la naturaleza de esos
elementos, puede verse que los dos primeros tendrán un claro
carácter metálico, por su tendencia a perder los electrones
de sus respectivos orbitales 3s, que les convierte en iones isoelectrónicos
con el gas noble anterior, el neón, y por tanto, como especies
químicas muy estables.
Na+: 1s2 2s2 2p6
Mg2+: 1s2 2s2 2p6
Lo mismo puede decirse del aluminio, al fin y al cabo está
más próximo a ceder esos tres electrones del nivel
3 que a poder enlazar mediante el establecimiento de un enlace covalente
con otro elemento. Así, también pasaría a tener
una configuración:
Al3+: 1s2 2s2 2p6
Entonces, el tipo de enlace que establecerán estos tres elementos
con el cloro (Z = 17) será de naturaleza iónica, pues
este elemento tiene tendencia a completar su última capa
captando un único electrón, y convirtiéndose
en:
Cl : 1s2 2s2 2p6 3s2
3p6
En los tres casos, pues, pueden formarse sólidos iónicos
de fórmulas: NaCl; MgCl2 y AlCl3, pues
con esas proporciones se produce la neutralidad global de cargas
en cada uno de los compuestos.
Sin embargo,
la unión del cloro con el elemento de Z = 15 es
distinta. Analizando las configuraciones electrónicas de
ambos elementos, observamos que los dos tienen tendencia a captar
electrones para completar su tercera capa: el P precisa 3 electrones
y el Cl sólo uno. Por tanto, podrán establecerse
tres enlaces covalentes entre un átomo de P con tres átomos
diferentes de Cl que darán lugar un compuesto de fórmula
PCl3, tricloruro de fósforo.
|
|
|
|
| Respuesta
5 |
a)
Las configuraciones electrónicas de los elementos que se
proponen son, referidas a la del gas noble anterior:
ZX
= 19; X = [Ar] 4s1
ZY = 17; Y = [Ne] 3s2 3p5
Con estos datos,
podemos llegar a identificar ambos elementos:
X se
encuentra en el primer grupo del Sistema Periódico, en la
familia de los alcalinos, y en el cuarto período (lo indica
el último orbital que se ha ocupado, el 4s). Se corresponde,
por tanto, a la estructura electrónica del potasio, K.
Y se
corresponde con el segundo elemento del grupo 17, pues en esa configuración
sólo falta un electrón para completar la estructura
equivalente a la de los gases nobles. Es la familia de los halógenos,
y el elemento Y es, por tanto, el cloro, Cl.
b)
La unión X Y es de tipo iónico. Esto se debe
a que están enfrentándose dos átomos de electronegatividades
muy diferentes, el Y, que sólo necesita un electrón
para completar su última capa, y el X, que precisa prescindir
de un electrón para alcanzar la configuración del
gas noble que le precede.
En tales
condiciones, cada uno de los átomos del elemento Y puede
captar un electrón de un átomo de X, con lo que
ambos se transforman en las especies iónicas:
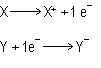
quedando
esas configuraciones electrónicas respectivas (que además
son isoelectrónicas):
X+:
[Ne] 3s2 3p6: [Ar]
Y:
[Ne] 3s2 3p6: [Ar]
y entre iones
de esas características se producirán las atracciones
eléctricas que los ordenarán como una red iónica,
cuya fórmula (que sólo expresará la proporción
entre iones de uno y de otro signo) será: XY, o, lo
que es lo mismo, referidos a las especies que ya hemos identificado,
KCl.
Por el contrario,
el tipo de unión Y Y se corresponde con un enlace covalente,
pues se trata de átomos de un elemento no metálico
uniéndose consigo mismo. Si recurrimos a los diagramas de
Lewis, podemos explicar la estructura de la molécula recordando
que la configuración electrónica de Y está
a falta de captar un electrón para lograr completarla y hacerse
isoelectrónica con la del gas noble Ar. Cuando esté
obligado a compartir, pondrá en juego uno de esos siete electrones
de su última capa para compartir con otro, en este caso de
su misma naturaleza.
Con ello tendremos
una especie molecular donde cada átomo de Y mantiene tres
pares de electrones sin compartir, y habrán establecido entre
ambos, un enlace covalente sencillo, compartiendo un par de electrones
según
la fórmula Y2, que particularizada en el elemento
ya identificado, resulta Cl2.
c)
El compuesto XY, al ser de carácter iónico, en
principio sí se disolverá en agua, según el
proceso de disociación iónica (que resulta inverso
al de su formación):
es decir:
El compuesto
Y2 no se disolverá en agua, pues al ser una
molécula homonuclear (formada por átomos del mismo
elemento), tendrá carácter apolar, y no podrá
interaccionar con el H2O por ser ésta una molécula
de carácter muy polar.
|
|
|
Pregunta 6
|
Disocia
los siguientes compuestos iónicos:
| NaCl |
CaCl2 |
AlCl3 |
SnCl4
|
Na2S |
BaS |
Fe2S3 |
| PbS2
|
KNO3
|
Ca(NO3)2 |
Fe(NO3)3 |
Na2CO3
|
CdCO3
|
|
|
Al2(CO3)3
|
Pb(CO3)2 |
CuNO3 |
CuCO3
|
K2CrO4
|
K2Cr2O7 |
|
|
|
| Respuesta
6 |
| La
disociación de un compuesto iónico es un importante
proceso que tiene lugar cuando éste se disuelve en agua,
y que supone la separación del compuesto en los iones que
lo forman. Por tanto, siempre lleva consigo una ruptura en dos especies:
el anión (ion negativo, casi siempre de naturaleza no metálica)
y el catión (ion positivo, casi siempre de naturaleza metálica)
del compuesto.
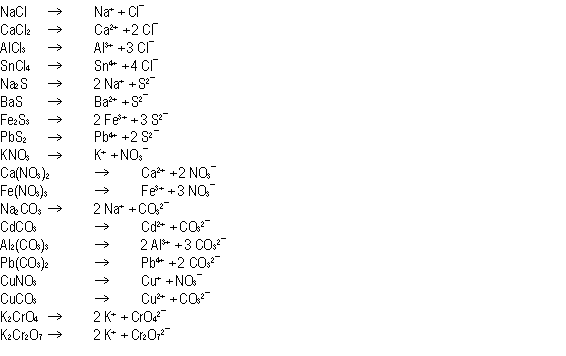
|
|
|
Pregunta 7
|
| Completa
la siguiente tabla, escribiendo las fórmulas de los compuestos
que se obtienen combinando los iones de distinto signo:
|
Ag+
|
Cu2+
|
Fe2+
|
Al3+
|
Sn4+
|
| I
|
|
|
|
|
|
| ClO3 |
|
|
|
|
|
| CO32
|
|
|
|
|
|
| CrO42
|
|
|
|
|
|
| PO43
|
|
|
|
|
|
|
|
| Respuesta
7 |
El
proceso de formación de compuestos que se propone es el inverso
al de disociación que hemos visto en la cuestión anterior.
El principio que debemos tener en cuenta es que los compuestos que
se obtienen deben ser, desde el punto de vista eléctrico,
neutros. Es decir, deberán compensarse sus cargas positivas
con las negativas.
Veamos algunos ejemplos en los que vamos a tratar el problema como
si ese proceso afectara a iones individuales, pero no debemos perder
de vista que en realidad el proceso afecta a grandes cantidades
de iones, en las proporciones que acaban reflejando las fórmulas.
Y que por tanto, para ser rigurosos, en vez de hablar de la neutralización
de un ion aislado, deberemos considerar que el proceso se da para
neutralizar un mol de esos iones.
I con Ag+. Bastará un ión de
cada para obtener un compuesto neutro: Yoduro de plata, AgI.
ClO3 con Cu2+. Deberán
unirse el doble de iones de ClO3 para neutralizar
uno sólo de Cu2+, formando por tanto el clorato
de cobre (II), Cu(ClO3)2.
ClO3 con Al3+. Deberán
unirse tres iones (tres moles de iones) ClO3
para neutralizar uno sólo de Al3+, formando por
tanto el clorato de alumnio, Al(ClO3)3.
CO32 con Ag+. Deberán
unirse dos iones Ag+ para neutralizar uno de CO32
, formando por tanto el carbonato de plata, Ag2CO3.
CO32 con Al3+. Deberán
unirse tres iones (moles de iones) CO32
(seis cargas negativas) para neutralizar dos de Al3+(que
suponen seis cargas positivas) formando por tanto el carbonato de
aluminio, Al2(CO3)3.
CrO42 con Sn4+. Deberán
unirse dos iones CrO42 (cuatro cargas negativas
en total) para neutralizar las cuatro cargas positivas de un catión
Sn4+, formando por tanto el cromato de estaño
(IV), Sn(CrO4)2.
PO43 con Al3+. Bastará
con que se una un anión PO43 (tres
cargas negativas) con un Al3+ formando por tanto el fosfato
de aluminio, AlPO4.
PO43 con Sn4+. Deberán
unirse cuatro iones PO43 (lo que en total
suponen doce cargas negativas) para neutralizar a tres iones Sn4+
(que en total hacen doce cargas positivas) formando por tanto
el fosfato de estaño (IV), Sn3(PO4)4.
Entonces la tabla completa queda como sigue:
| |
Ag+
|
Cu2+
|
Fe2+
|
Al3+
|
Sn4+
|
| I |
AgI |
CuI2 |
FeI2 |
AlI3 |
SnI4 |
| ClO3 |
AgClO3 |
Cu(ClO3)2 |
Fe(ClO3)2 |
Al(ClO3)3 |
Sn(ClO3)4 |
| CO32
|
Ag2CO3 |
CuCO3 |
FeCO3 |
Al2(CO3)3 |
Sn(CO3)2 |
| CrO42
|
Ag2CrO4 |
CuCrO4 |
FeCrO4 |
Al2(CrO4)3 |
Sn(CrO4)2 |
| PO43
|
Ag3PO4 |
Cu3(PO4)2 |
Fe3(PO4)2 |
AlPO4 |
Sn3(PO4)4 |
|
| Respuesta
8 |
El
enlace de hidrógeno se establece entre moléculas que
presentan un átomo de hidrógeno enlazado directamente
con alguno de los elementos más pequeños y más
electronegativos del Sistema Periódico, es decir, con flúor,
con oxígeno y con nitrógeno. Por tanto, pueden aparecer
enlaces de hidrógeno en el ácido fluorhídrico,
HF, en moléculas que tengan, al menos, un enlace OH (pueden
ser los dos, como en el agua, H2O), o uno NH (pueden
ser también dos o los tres, como en el amoníaco, NH3).
Esto hace que enlace covalente que se establece entre esos elementos
y el hidrógeno esté altamente polarizado, y las interacciones
que se puedan dar entre las moléculas con esta características
(enlaces de hidrógeno) sean las más intensas que se
conocen (dentro de los compuestos covalentes).
Como consecuencia de lo anterior, en esos compuestos aparece, sobre
los átomos que hemos citado (F, O y N) una notable densidad
de carga negativa, consecuencia de la elevada tendencia que tienen
los tres por atraer los electrones de los enlaces que ellos mismos
forman (es decir, consecuencia de su elevada electronegatividad).
Si por ejemplo tomamos el F en el HF, podemos ver que sobre el F
se situará una elevada densidad de carga negativa (que representamos
por d ), quedando los
átomos de hidrógeno prácticamente convertidos
en protones, creándose a su alrededor un intenso campo eléctrico
que les lleva a enlazarse como puentes entre distintos átomos
de flúor de otras moléculas por tratar de neutralizar
esas cargas parciales que han aparecido dentro de las moléculas.
Esto lleva consigo un ordenamiento más acentuado de esas
moléculas, de tal modo que, las sustancias que presentan
enlaces intermoleculares por enlace de hidrógeno, a temperatura
ambiente son líquidas o sólidas, pero nunca gaseosas.
Tienen enorme trascendencia los enlaces de hidrógeno que
aparecen en las moléculas y macromoléculas que conforman
los seres vivos (aminoácidos, proteínas, DNA
), y
en su comportamiento bioquímico.
Para los ejemplos concretos que se plantean, podemos ver que:
En el caso del etano, CH3CH3 (se trata de
un hidrocarburo) no se producen enlaces de hidrógeno,
porque no existe ninguna unión directa de átomos de
O ni de N con H.
Para el dimetiléter, CH3OCH3, (se
trata de un éter) tampoco se producirán enlaces
de hidrógeno, pues aunque aparece un átomo de oxígeno
en la molécula, no hay ningún enlace directo de este
con alguno de los átomos de H (el átomo de O se une
directamente a los dos átomos de C).
Sin embargo, en el caso del metanol, CH3OH (es un alcohol)
sí se producirán esos enlaces de hidrógeno,
pues aparece en la molécula un grupo OH donde sí
se ha establecido una unión directa entre el átomo
de oxígeno y un átomo de hidrógeno.
En el caso del etanal, CH3CHO, si analizamos detenidamente
su estructura molecular, veremos que tampoco aparece una
unión directa del átomo de O con el del hidrógeno
(la unión del C al O se establece por un doble enlace, quedando
ese H unido directamente también al átomo de C), por
lo que en este tipo de compuestos (es un aldehído) tampoco
se establecerá entre sus moléculas esas fuerzas intermoleculares
del tipo enlace de hidrógeno.
Finalmente, para el ácido propanoico, CH3CH2COOH,
(es uno de los llamados ácidos orgánicos) vuelve a
aparecer en la molécula un grupo OH que se une al último
C (al que además se une el otro O con un doble enlace), por
lo que, al igual que en el caso del CH3OH, sí
se darán las uniones por enlaces de hidrógeno entre
sus moléculas. |
|
Pregunta 9
|
| Contesta
razonadamente:
a)
¿Por qué el agua es un líquido en condiciones
normales y el sulfuro de hidrógeno es un gas?
b) ¿Cuál de los siguientes
compuestos tendrá el mayor punto de fusión: el fluoruro
de sodio o el bromuro de potasio?
c) ¿Cuál de los siguientes compuestos será
más soluble en agua: el yoduro de cesio o el óxido
de calcio?
|
| Respuesta
9 |
a)
Nos encontramos ante dos compuestos covalentes clásicos:
H2O y H2S, resultado de la unión entre
átomos de no metales, de características similares.
Ambos presentan dos enlaces con hidrógeno, y en ambos casos
el átomo central pertenece al mismo grupo del sistema periódico:
el oxígeno y el azufre.
Las propiedades físicas de las moléculas derivan del
tipo de fuerzas intermoleculares que se establecen entre ellas,
y aquí es donde aparece la diferencia entre el agua (líquida)
y el sulfuro de hidrógeno (gaseoso).
Ambas son moléculas polares, pero el H2O presenta
fuerzas intermoleculares denominadas enlaces de hidrógeno,
pues el enlace OH está altamente polarizado, debido a la
gran electronegatividad y pequeño tamaño del oxígeno,
en comparación con el azufre. Ello crea unas interacciones
tan intensas, que los hidrógenos parecen pasar a establecerse
como puentes entre los átomos de oxígeno de moléculas
vecinas, por mera atracción electrostática entre las
densidades de carga parcial que se crean en cada molécula.
Como resultado de esto, las fuerzas intermoleculares en ambos casos
son distintas: H2O enlaces de hidrógeno, H2S
interacciones Van der Waals de tipo dipolo-dipolo (mucho más
débiles). Y a pesar de que un aumento en el tamaño
molecular incrementa asimismo la magnitud de las interacciones intermoleculares,
en este caso la diferencia de tamaños entre el S y el O no
es suficiente como para evitar que el agua, a temperatura ambiente,
siga siendo un líquido frente al H2S.
b) Ambos son compuestos iónicos: NaF y KBr.
Para deducir cuál tendrá mayor punto de fusión,
tenemos que saber en qué caso los iones se encuentran más
fuertemente unidos. Esto depende directamente de dos características:
de la carga de los propios iones que forman el compuesto (pues se
encontrarán más fuertemente unidos cuanto más
elevada sea esa carga) y de su tamaño (pues, en principio,
los iones más grandes se encontrarán más alejados,
y la atracción entre ellos será menor). En nuestro
caso, tenemos dos compuestos formados por:
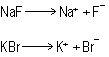
Si analizamos
la composición de ambos compuestos (en referencia a su
disociación) tendremos:
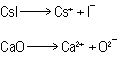
En el CaO
los iones están más fuertemente unidos, porque presentan
carga 2+/2 frente a la carga +/ del CsI. Pero además,
en el caso del CaO, el tamaño de sus iones es mucho menor
que los del CsI (lo que se deduce de sus posiciones respectivas
en el Sistema Periódico), con lo que en este caso tenemos
que ambos factores hacen que los iones, en el caso del CaO se
encuentren mucho más fuertemente enlazados que en el CsI,
y por tanto, se disolverá mucho peor en agua el CaO que
el CsI.
|
| Respuesta
10 |
El
problema supone plantear el llamado ciclo de Born-Haber, donde se
recogen todas las magnitudes energéticas que intervienen
en la formación de un compuesto iónico (a partir de
sus iones en estado gaseoso). En
nuestro caso, las reacciones que pueden plantearse son:
Donde hemos aplicado a los procesos que se señalan las definiciones
de energía de formación (del KBr a partir de sus elementos
en estado fundamental), y de energía reticular (del KBr a
partir de sus iones en estado gaseoso). Nótese
que se toma el valor de ½ Ed para la disociación
del Br2 gaseoso porque en nuestra reacción sólo
se precisa un mol de átomos de Br, y su disociación
da lugar a dos moles:
Puede observarse cómo:
Sustituyendo en esta expresión los datos de que disponemos:
–93,7
kcal/mol = (–19,4 kcal/mol) + 1/2 (46,3 kcal/mol) + 100,1
kcal/mol + (–77,0 kcal/mol) + Er
de donde:
Er
= –120,55 kcal/mol
|
|