|
Pregunta 1
|
| El dióxido
de azufre reacciona con oxígeno gaseoso para formar trióxido
de azufre, según la reacción:
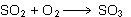
a) ¿Cuántos gramos
de trióxido de azufre podrán prepararse a partir
de 23,5 g de dióxido de azufre?
b) ¿Qué volumen
de oxígeno medido en condiciones normales se necesita para
que reaccione todo el dióxido de azufre?
Datos: masas atómicas:
S = 32; O = 16; R = 0,082 atm L K–1
mol–1.
|
|
| Respuesta
1
|
| La reacción
ya ajustada queda:
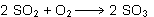
a) Para calcular la masa
de SO3 que puede obtenerse a partir de esa cantidad
de dióxido de azufre, expresamos en moles el valor a que
equivalen sus 23,5 g:
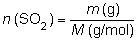
donde M
es la masa molar del SO2 (64 g/mol), luego:
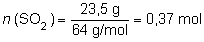
analizando
la proporción estequiométrica entre el SO2
y el SO3 (que es de 2:2, es decir, 1:1), deducimos
que el número de moles de SO3 también
será de 0,37 mol.
Para expresarlo en gramos, si recurrimos
a la masa molar del SO3 (80 g/mol):
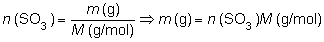
luego:
b) Para calcular el volumen
de O2, de nuevo analizamos la relación estequiométrica
entre el SO2 y el O2, que es 2 a 1. Por
tanto:
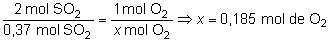
y, al ser un gas, podemos aplicar
la ecuación de los gases ideales:
pV =nRT
donde recordamos que las condiciones
normales suponen una temperatura de 0 ºC (273 K) y una presión
de 1 atm, luego:
1 atm · V = 0,185 mol · 0,082 atm L K–1
mol–1 · 273 K Þ
V = 4,14 L
|
|
|
|
| Respuesta
2 |
| La reacción
a que se refiere el enunciado, ya ajustada, es:
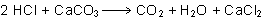
a) Para poder relacionar
estequiométricamente al CaCO3 con el CaCl2,
debemos determinar a qué cantidad en moles equivalen esos
2,50 kg (2 500 g) de cloruro de calcio, cuya masa molar podemos
calcular fácilmente (111 g/mol).
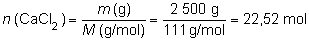
En la reacción
ajustada, observamos que la relación entre el CaCO3
con el CaCl2 es de uno a uno. Es decir, precisaremos
asimismo 22,52 mol de carbonato para obtener esos 2,5 kg de cloruro
de calcio, que expresados en gramos:
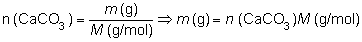
m
(g) = 22,52 mol · 100 g/mol = 2 252 g de CaCO3
Por último, como el reactivo
de que disponemos es caliza de un 92 % de riqueza, precisaremos
tomar una cantidad superior a los 2 252 g, para asegurarnos la
presencia de esa cantidad de carbonato en la caliza:
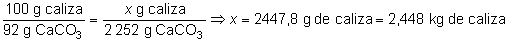
b) Para determinar el
volumen de CO2, observamos que también la proporción
entre éste y el cloruro o el carbonato de calcio es de
uno a uno. Por tanto, ya sabemos que se van a obtener asimismo
22,52 mol de CO2 en el proceso.
Basta expresar este dato en forma de
volumen, para ello recurrimos a la ecuación de los gases
ideales:
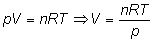
luego:
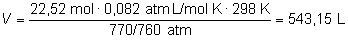
|
|
Pregunta 3
|
| En la tostación
de la pirita según la reacción (ajustada sólo
en los reactivos):
2 FeS2 +
11/2 O2 ® SO2
+ Fe2O3
Determina:
a) La cantidad de dióxido de azufre que se
obtiene al tostar dos toneladas de pirita de un 90 % de riqueza,
si el resto es ganga silícica.
b) El volumen de aire, medido a 298 K y a 1 atm
de presión que se necesita para tostar dicha cantidad de
mineral. El aire contiene el 21 % en volumen de oxígeno.
Datos: masas atómicas: S = 32; Fe = 56; O = 16. R
= 0,082 atm L/K mol.
|
|
| Respuesta
3 |
| En primer
lugar ajustamos completamente la reacción:
2 FeS2 +
11/2 O2 ® 4 SO2
+ Fe2O3
a) Si disponemos de 2 toneladas de pirita (2 · 106
g) de un 90 % de riqueza (el resto no interesa, pues es otra sustancia)
disponemos en realidad de:

Para poder
entrar en las relaciones estequiométricas de la reacción,
determinamos a cuántos moles de sulfuro de hierro equivale
esta cantidad, sabiendo que la masa molar del FeS2
es de 120 g/mol:
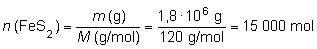
Por tanto,
entrando en la relación estequiométrica de la reacción,
tendremos:

que es la
cantidad que se obtiene de SO2. Como no se indica otra
cosa, la expresaremos, por ejemplo, en gramos, teniendo en cuenta
que la masa molar del SO2 es 64 g/mol:
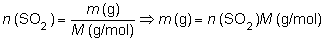
luego:
m (g) = 1,92
· 106 g de SO2 = 1 920 kg de SO2
b) Para conocer el volumen de aire que se precisa, calculamos
los moles de O2 que se habrán consumido, según
la relación estequiométrica de la reacción:

por tanto,
el volumen de oxígeno al que equivale esa cantidad será:

Como ese oxígeno
procede del aire, que contiene un 21 % en volumen del gas, el
volumen de aire que se precisa será mayor (tal que nos
asegure la presencia de esa cantidad de oxígeno puro para
la reacción):
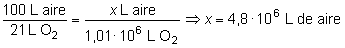
|
|
|
Pregunta 4
|
| Se tratan
6 g de aluminio con 50 cm3 de disolución acuosa
de ácido sulfúrico 0,15 M. Sabiendo que la reacción
que tiene lugar es:
H2SO4
+ Al ® Al2(SO4)3
+ H2
Calcula:
a) El volumen de hidrógeno que se obtendrá
a partir de la reacción, medido a 20 ºC y 745 mmHg.
b) El peso de sulfato de aluminio (III) que se obtendrá
como resultado de la reacción.
Datos: masas atómicas: H = 1; S = 32; O = 16; Al = 27.
R = 0,082 atm L/K mol.
|
|
| Respuesta
4
|
| a)
La reacción ajustada sería:
3
H2SO4 + 2 Al ®
Al2(SO4)3 + 3 H2
Para calcular el volumen de hidrógeno
que se pide, debemos referir los datos a las proporciones estequiométricas
de la reacción. Es decir, determinar los moles de cada
reactivo que se consumen en el proceso, para determinar así
cuál de ellos está en exceso, y cuál es el
reactivo limitante (que se encuentra en menor cantidad y reaccionará
completamente): Para el aluminio, al tratarse de un sólido:
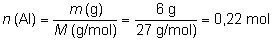
Para el H2SO4,
al tratarse de una disolución, recurrimos al concepto de
molaridad (M):
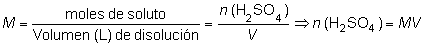
Luego, sustituyendo los datos:
n
(H2SO4) = 0,15 M · 0,05 L = 7,5 ·
10–3 mol
Con ambos datos, podemos determinar
que habrá un exceso de Al, pues la cantidad de H2SO4
es muy inferior (se trata del reactivo limitante), y por cada
3 moles de H2SO4 reaccionan 2 de Al. Por
ello, al existir sólo 0,0075 moles de ácido, la
cantidad de aluminio que puede reaccionar es:
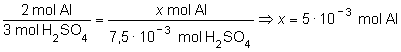
es decir,
solo reaccionaran 5 · 10–3 mol de Al de los 0,22
disponibles.
Para resolver, pues, el problema, bastará considerar como
dato los moles de reactivo limitante (H2SO4),
luego para determinar las cantidad de H2 producida,
recurrimos de nuevo a las proporciones estequiométricas:
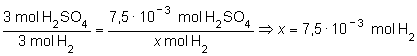
y para expresar el resultado en litros,
bastará aplicar la ecuación de los gases ideales:
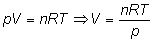
luego:
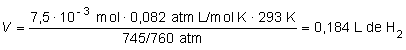
b) Procedemos de la misma
manera para calcular la masa de sulfato de aluminio:
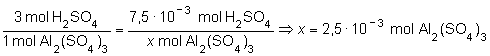
y para expresarlo
en gramos:
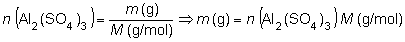
m
(g) = 2,5 · 10–3 mol de Al2(SO4)3
· 342 g/mol = 0,855 g de Al2(SO4)3
|
|
|
|
| Respuesta
5 |
| La reacción
a que se refiere el problema, ya ajustada, es:
2 Al + 6 HCl ®
2 AlCl3 + 3 H2
Para resolver el problema,
debemos referir nuestros datos a las relaciones estequiométricas
que aparecen en la reacción anterior. En nuestro caso,
si disponemos de una muestra de 100 g de aluminio del 81 % de
riqueza, debemos considerar que, como reactivo, disponemos de
81 g de Al (81 % de 100 g).
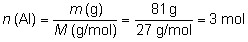
a)
Estableciendo la relación estequiométrica correspondiente
determinamos la cantidad de ácido clorhídrico que
reaccionará con la muestra:
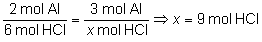
Como ese resultado
se pide en forma de un volumen de disolución, recurriremos
a la expresión de la molaridad:
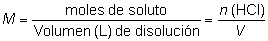
de donde:

b)
Procedemos de la misma manera para determinar la cantidad de hidrógeno
que se obtendrá en la reacción:
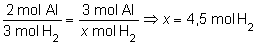
Como ese resultado
se pide en forma de un volumen gaseoso, recurrimos a la ley de
los gases ideales:
pV
= nRT
de donde:
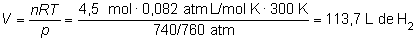
|
|
|
|
| Respuesta
6 |
| Para resolver
las cuestiones que se plantean, debemos recurrir al proceso de obtención
del acetileno, que, según se indica, (ya ajustado) es:
CaC2 + 2
H2O ® C2H2
+ Ca(OH)2
a) Para conocer el número
de latas que habrán de adquirirse, debemos calcular en
primer lugar a qué cantidad (en mol) corresponden esos
760 litros de acetileno, en las condiciones que se indican (p
= 1 atm, T = 306 K), que al ser gaseoso podemos obtener
a partir de la ecuación de los gases ideales:
pV = nRT
de donde:
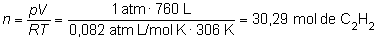
Como la relación
entre el CaC2 y el C2H2 es uno
a uno, ese volumen de acetileno precisará del empleo de
30,29 moles de carburo de calcio, que en gramos equivale a:
m (g) = n
(C2H2) M(g/mol) = 30,29 mol de
C2H2 · 64 g/mol = 1 938,56 g de CaC2
Por último, habrá que considerar que la pureza del
carburo de calcio empleado es del 87 %, lo que nos indica que
deberemos adquirir una masa superior de CaC2 para asegurarnos
que contenga la cantidad que precisamos (esos 1 938,56 g), luego:
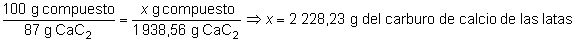
Y ya que cada
lata contiene 500 g de carburo de calcio, harán falta:
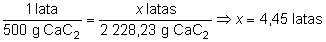
Es decir,
necesitamos adquirir 5 latas de las que vende el fabricante, aunque
de una de ellas empleemos sólo la mitad.
b) Para calcular el peso de Ca(OH)2 que
se forma en el proceso, recurrimos de nuevo a la proporción
estequiométrica de la reacción, que también
es de uno a uno entre el Ca(OH)2 y el C2H2.
Por tanto, se obtendrán asimismo 30,29 mol de Ca(OH)2.
Y para expresarlo en gramos, considerando que la masa molar del
Ca(OH)2 es de 74 g/mol:
m (g) = n (Ca(OH)2) M(g/mol) = 30,29
mol de Ca(OH)2 · 74 g/mol = 2 241,46 g de Ca(OH)2
|
|
|
Pregunta 7
|
|
La nitroglicerina, de fórmula C3H5(NO3)3,
es un explosivo que se descompone según la reacción:
4 C3H5(NO3)3 (l) ®
12 CO2 (g) + 10 H2O (g) + O2
(g) + 6 N2 (g)
para
la cual DHo
= –5 700 kJ, a 25 ºC.
a) Calcule la entalpía de formación
estándar de la nitroglicerina, sabiendo que las entalpías
de formación estándar del dióxido de carbono
y del agua son, respectivamente, –393 y –242 kJ/mol,
a 25 ºC.
b) Calcule el calor desprendido cuando se descomponen
30 g de nitroglicerina.
Datos: masas atómicas: C = 12; O = 16; H = 1; N = 14.
|
|
| Respuesta
7
|
| a)
Aplicando la ecuación:
DHr
= S DHproductos
- S
DH reactivos
llegamos a:
y sustituyendo
los datos:
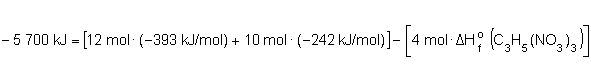
de donde:
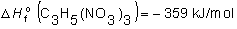
b)
Para calcular el calor que se desprende cuando se descomponen
30 g de nitroglicerina, debemos referirnos a la entalpía
del proceso que se indica:
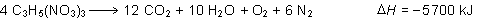
y calcular el número de moles
de nitroglicerina equivalente a esos 30 g, para poder emplear
ese dato (debemos fijarnos que ese valor de 5 700 kJ se refiere
a la descomposición de 4 moles de nitroglicerina):
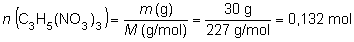
luego:
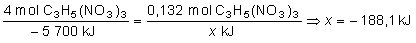
|
|
|
Pregunta 8 |
| Durante
la década de los años cuarenta y debido a la escasez
de gasolina, se utilizó como combustible para automóviles
el monóxido de carbono obtenido a partir del carbón
en los «gasógeno». Sabiendo que la combustión del
CO (g) para dar CO2 (g) tiene una variación de
entalpía de –283 kJ/mol.
a) Calcula la variación
de entalpía del monóxido de carbono.
b) ¿Qué cantidad de calor se podría
obtener al quemar 100 m3 de CO medidos a 25 ºC y 750
mmHg?
c) ¿Qué volumen ocuparía el O2
(g) necesario para la combustión del apartado anterior,
medido en las mismas condiciones de presión y temperatura
que el CO?
Datos: R = 0,082 atm L/K mol;
DHfo
(CO2, g) = -393,5 kJ/mol.
|
|
| Respuesta
8 |
| a)
La reacción a que se refiere el enunciado es:
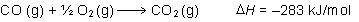
que hemos ajustado con relación
a la combustión de 1 mol de CO.
A partir de la expresión 6.1:
DHr = S
DHproductos –
S DHreactivos
de donde:
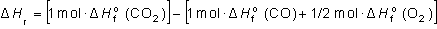
y sustituyendo
datos:
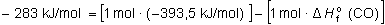
llegamos a:
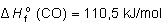
b) Para
resolver esta cuestión, necesitamos calcular previamente
la cantidad (en mol) de monóxido de carbono,
y puesto que es un gas aplicaremos la ecuación de los gases
ideales:
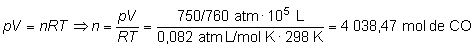
dado que se
desprenden –283 kJ al quemar un mol de monóxido de carbono,
para 4 038,47 mol se desprenderán:
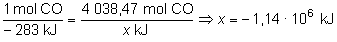
c)
La relación estequiométrica entre el O2
y el CO es la siguiente:
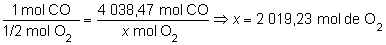
que llevados
a la ecuación de los gases ideales:
0,987 atm · V
= 2 019,23 mol · 0,082 atm L/mol K · 298 K Þ
V = 50 m3 de oxígeno
Podía también haberse
calculado directamente, ya que para la combustión de 100
m3 de CO, las mismas proporciones estequiométricas
indican que en volúmenes se precisaría la mitad
de O2, (1 CO reacciona con ½ de O2), es
decir, 50 m3.
|
|
|
|
| Respuesta
9 |
| La reacción
cuya entalpía se pide, ya ajustada, es:
C3H8
+ 5 O2 ® 3 CO2
+ 4 H2O
Se
trata de una combustión, es decir, una reacción
donde un compuesto se combina con el oxígeno para formar
dióxido de carbono y agua (si el compuesto es orgánico,
como es el propano).
Para calcular su variación de entalpía, recurrimos
a la ecuación 6.1:
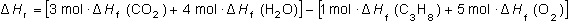
Y sustituyendo los datos del problema:
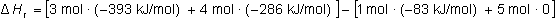
Es decir:
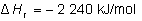
Para calcular el calor que se desprende cuando se queman 440 g
de propano, debemos referirnos a la entalpía de combustión
del propano que acabamos de calcular:
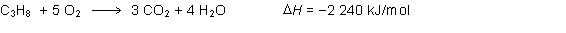
y ya que el valor viene definido por
mol de propano, tendremos que calcular los moles a que equivalen
esos 440 g de propano:
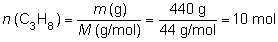
luego:
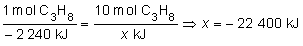
Sin embargo,
como en el enunciado se pide ese resultado en calorías,
deberemos realizar un último cambio de unidades, considerando
que 1 J = 0,24 calorías:
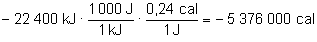
|
|
|
Pregunta 10
|
|
El carburo de calcio, CaC2, cuando reacciona con agua
produce hidróxido de calcio y acetileno (C2H2),
según la reacción:
CaC2 + H2O
® Ca(OH)2 + C2H2
Al reaccionar
32 g de carburo de calcio impuro y quemarse completamente el acetileno
producido, el dióxido de carbono obtenido ocupó
un volumen de 24 litros a 700 mmHg y 20 ºC.
a) Calcula la riqueza del carburo de calcio.
b) Calcula el volumen de oxígeno, medido
a 20 ºC de temperatura y 700 mmHg de presión, necesario
para quemar el acetileno producido.
Datos: R = 0,082 atm L/K mol; Masas atómicas: H
= 1; C = 12; Ca = 40; O = 16.
|
|
| Respuesta
10 |
| a) En este
problema se contemplan dos reacciones sucesivas, que ya hemos ajustado:
CaC2 + 2
H2O ® Ca(OH)2
+ C2H2 (obtención del acetileno,
C2H2)
C2H2 +
5/2 O2 ® 2 CO2
+ H2O (combustión del acetileno)
Recordamos
que la combustión es una reacción donde un compuesto
se combina con el oxígeno para formar dióxido de
carbono y agua (si el compuesto es orgánico, como el acetileno).
El dato de que se dispone para hacer el problema es el volumen
de CO2 obtenido. A partir del mismo, y para poder entrar
a analizar las cantidades estequiométricas de los reactivos
y productos, conviene determinar a cuántos moles equivale
ese volumen, luego a través de la ecuación de los
gases ideales:
pV
= nRT
de donde:
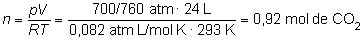
Y teniendo
en cuenta la relación estequiométrica entre el C2H2
y el CO2:
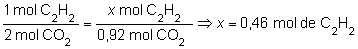
Si ahora consideramos
la relación estequiométrica entre el C2H2
y el CaC2 de la primera reacción:
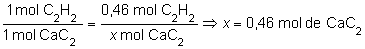
que traducido
en gramos:
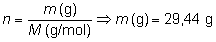
Es decir,
para obtener 24 litros de CO2 nos harían falta
29,44 g de carburo de calcio.
Si ahora comparamos ese dato con el que indican (se han empleado
32 g de carburo de calcio impuro), podremos calcular su riqueza,
calculando el porcentaje entre ambos datos:
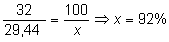
b)
Para calcular el volumen de O2 requerido, procedemos
de un modo similar, analizando las relaciones estequiométrica
en la segunda reacción:
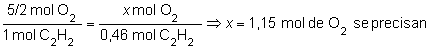
Como las condiciones
son las mismas que para el CO2, de nuevo aplicando
la ecuación de los gases ideales llegamos a:
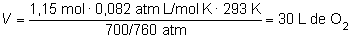
|
|