|
|
| Respuesta
1
|
El
nombre de las especies señaladas, aplicando las reglas estudiadas,
es el siguiente:
a)
1,2–pentadieno.
b)
2–pentanona.
c)
Dietiléter.
d)
Metilamina.
e)
Propanal.
f)
1,4–diclorobutano.
g)
Etanol.
h)
Metanoato de metilo.
i)
Propanonitrilo.
j)
Ácido pentanoico.
k)
3–buten–2–ol.
l)
Trimetilamina. |
|
|
|
| Respuesta
2 |
Haremos
uso de las reglas vistas en la UNIDAD 7 para la formulación
de los compuestos del carbono.
a) CH3–CH2–CHCl–CH2–CH2Cl
b) CH3–CH2–CH2OH
c) CH3–CH2–COO–CH2–CH3
d) CH3–CH2–CH2–CN
e) HOOC–COOH
f) CH3–CH2–CH=C=CH2
g) CH3–CH2–CH2–CO–CH3
h) CH3–CH2–O–CH2–CH2–CH3
i) CH3–CH2–CH2–CHNH2–CH3
j) HOC–CH2–CHO
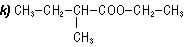
l)
CH3–CH2–CO–CH2–CH3 |
|
| Respuesta
3 |
Las
fórmulas que se indican corresponden a los siguientes compuestos:
a) 3–metilhexano.
b) Ácido 2–butenoico.
c) Ácido 3–hidroxipropanoico.
d) 1–buteno.
e) Etilmetiléter.
Los isómeros
son compuestos que presentan la misma fórmula molecular pero
diferente estructura molecular. Y así, los ejemplos que se
piden podrían ser:
 Para
el primero, el 3–metilhexano, un isómero de cadena será
otra molécula que también se ajuste a la fórmula
C7H16, pero que presente un esqueleto carbonado
diferente. Por ejemplo, el heptano, cuya cadena es lineal en vez
de ramificada: Para
el primero, el 3–metilhexano, un isómero de cadena será
otra molécula que también se ajuste a la fórmula
C7H16, pero que presente un esqueleto carbonado
diferente. Por ejemplo, el heptano, cuya cadena es lineal en vez
de ramificada:
CH3–CH2–CH2–CH2–CH2–CH2–CH3
 Para el último, recordemos que los isómeros de función
son aquellos que, presentando la misma fórmula empírica,
difieren en la función orgánica a que pertenecen.
Así, un isómero del metiletiléter, cuya fórmula
empírica se ajusta a C3H8O podría
ser, por ejemplo, el 1–propanol:
Para el último, recordemos que los isómeros de función
son aquellos que, presentando la misma fórmula empírica,
difieren en la función orgánica a que pertenecen.
Así, un isómero del metiletiléter, cuya fórmula
empírica se ajusta a C3H8O podría
ser, por ejemplo, el 1–propanol:
CH3–CH2–CH2–OH
|
|
|
|
| Respuesta
4
|
Se
entiende por isómeros a los compuestos orgánicos que
presentan la misma fórmula molecular pero difieren en la
fórmula estructural del compuesto. Es decir, son compuestos
formados por los mismos átomos, en la misma cantidad y proporción,
pero corresponden a estructuras moleculares distintas.
La isomería
estructural (también llamada plana) puede explicarse sobre
el papel, y basta considerar cuál es la fórmula semidesarrollada
del compuesto para entenderla, pues hay otro tipo de isomería
que requiere visualizar la estructura espacial del compuesto o su
fórmula desarrollada para poder apreciarse: es la estereoisomería.
Dentro
de la isomería estructural, podemos considerar tres casos:
 Isomería de cadena. Los compuestos isómeros que la
presentan sólo difieren en el esqueleto carbonado que poseen.
Isomería de cadena. Los compuestos isómeros que la
presentan sólo difieren en el esqueleto carbonado que poseen.
 Isomería de posición. Son isómeros que, teniendo
el mismo esqueleto carbonado, difieren en la posición de
un mismo grupo funcional que determina la función orgánica
a la que ambos pertenecen.
Isomería de posición. Son isómeros que, teniendo
el mismo esqueleto carbonado, difieren en la posición de
un mismo grupo funcional que determina la función orgánica
a la que ambos pertenecen.
 Isomería de función. Se da entre compuestos que presentan
distintos grupos funcionales.
Isomería de función. Se da entre compuestos que presentan
distintos grupos funcionales.
a)
Se trata de
dos isómeros de función, pues pertenecen respectivamente
al grupo de los aldehídos y de las cetonas, compuestos que
son muy similares en cuanto a su comportamiento químico,
pues ambos poseen un grupo carbonilo, aunque presentan distinto
comportamiento frente a algunas reacciones (por ejemplo, frente
a su oxidación).
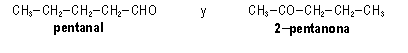
b)
Se trata de dos isómeros de posición,
pues ambos pertenecen al grupo de las cetonas, pero presentan
el grupo funcional en carbonos distintos, dentro del mismo esqueleto
carbonado.
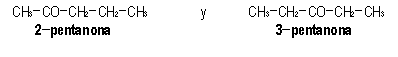
c)
Se trata de dos isómeros de cadena, pues
difieren en la estructura del esqueleto carbonado.
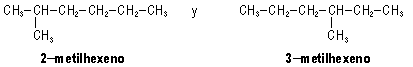
|
|
|
|
| Respuesta
5 |
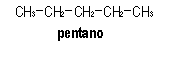
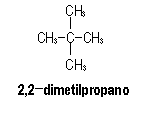
| Para
el C5H12 pueden formularse sólo tres
alcanos isómeros, que difieren en el esqueleto carbonado,
por lo que se corresponden con isómeros de cadena, y que
son los que siguen:
 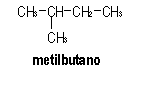 
Ninguno de
ellos presenta estereoisomería (óptica o geométrica).
|
|
|
|
| Respuesta
6 |
Para
el C5H10 pueden formularse una serie de alquenos
isómeros, como los que siguen:
|
CH2=CH–CH2–CH2–CH3
|
CH3–CH=CH–CH2–CH3
|
|
1–penteno
|
2–penteno
|
El 2–penteno
puede
presentar isomería geométrica de tipo cis-trans, por
la presencia de un enlace rígido (doble) que enlaza a dos
átomos de carbono con sustituyentes distintos. Eso hace que
en el espacio puedan darse dos estructuras diferentes para la misma
molécula del 2–penteno. La
nomenclatura cis-trans asigna el nombre de cis al isómero
que mantiene grupos similares a ambos lados del plano perpendicular
que contiene a los dos átomos de carbono que participan en
el doble enlace, y el nombre trans al otro isómero.
Según
esto, los dos posibles isómeros del 2–penteno son:
|
|
|
|
cis–2–penteno
|
trans–2–penteno
|
Los otros
alquenos isómeros del C5H10 son:
|
|
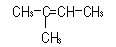 |
|
|
2–metil–1–buteno
|
2–metil–2–buteno
|
3–metil–1–buteno
|
ninguno de
estos tres alquenos presenta estereoisomería, ya sea óptica
(no hay ningún carbono asimétrico en esas moléculas)
o geométrica tipo cis-trans, porque en todos los casos,
uno de los dos carbonos que participa en el doble enlace tiene
dos sustituyentes iguales.
|
|
|
|
| Respuesta
7 |
| Cuando
hablamos de una molécula orgánica que presenta un
carbono asimétrico, nos referimos a la existencia de un átomo
de carbono que se encuentra unido a cuatro sustituyentes diferentes.
Ello da lugar a dos estructuras espaciales distintas para la molécula,
los llamados isómeros ópticos o enantiómeros.
Si la molécula presenta más de un carbono asimétrico,
las estructuras espaciales de ellas se multiplican.
a)
3–metil–2–butanona:
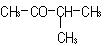
ningún
átomo de carbono de este compuesto presentará actividad
óptica, pues ninguno se encuentra unido a cuatro grupos
diferentes.
b)
Ácido 2–propenoico:
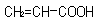
tampoco se
darán isómeros ópticos en este compuesto,
ni siquiera la isomería geométrica de tipo cis-trans
que puede afectar a moléculas con dobles enlaces, porque
cada unos de los dos átomos que intervienen en el doble
enlace no están unidos a sustituyentes distintos.
c)
2,3–butanodiol:
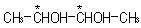
en este caso,
los átomos de carbono 2 y 3 son asimétricos, y los
que marcamos con *, pues cada uno de ellos está unido a
un H, un CH3, un OH y al resto de la cadena. Por tanto,
cabría hablar de cuatro posibles isómeros.
d)
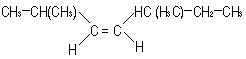
2,5–dimetil–3–hepteno:
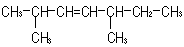
en este caso,
ningún átomo de carbono es asimétrico, por
lo que la molécula no presentará isomería
óptica. Sin embargo, la presencia del doble enlace sí
es responsable de que el compuesto presente dos estructuras distintas
en el espacio, es decir, isomería geométrica de
tipo cis-trans. Así, tenemos:
 |
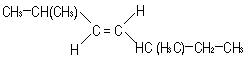 |
|
cis–2,5–dimetil–3–hepteno
|
trans–2,5–dimetil–3–hepteno
|
pues se denomina
isómero cis al que mantiene a grupos similares al mismo
lado del plano perpendicular que contiene al doble enlace, e isómero
trans al otro.
|
| Respuesta
8 |
| a)
Para determinar la fórmula molecular del hidrocarburo, referiremos
los datos de su análisis elemental (calculados sobre una
muestra de 100 g de compuesto) a un número de moles de sus
átomos, considerando que las masas atómicas del C
y del H son respectivamente 12 y 1 g/mol.
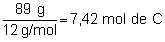
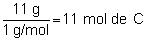
Para encontrar
la fórmula del compuesto, referiremos estos resultados
a un número entero, pues así se presentarán
en la molécula. Para ello, dividimos ambos datos por el
número menor (de este modo suponemos que de él habrá
1 átomo en el compuesto).

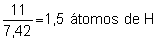
Vemos que
la proporción que hemos obtenido sigue siendo fraccionaria.
Por eso, para que el número de átomos sea una cantidad
entera, basta ver que esa misma proporción 1 a 1,5 se da
entre los números 2 a 3. Por
tanto, la fórmula empírica del compuestos será
C2H3, que evidentemente sólo nos
indica la proporción entre sus átomos, pues no se
corresponde con ningún compuesto posible.
b)
Para determinar la fórmula molecular del compuesto, tenemos
que conocer su masa molar. Y para hallarla, aplicamos la ecuación
de los gases ideales en condiciones normales (presión p
= 1 atm, temperatura 0 ºC, por tanto T = 273 K ), ya que
indican que en tales condiciones, disponemos de una muestra que
ocupa 3,73 L:
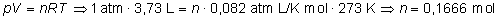
y como además:
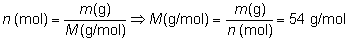
Comparando
la masa molecular con la masa de la fórmula empírica
y sabiendo que los átomos en la fórmula empírica
guardan la misma relación que en la molecular:
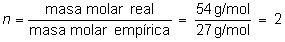
Luego el
compuesto buscado es el C4H6.
Esa
fórmula, puede corresponder a varios compuestos, es decir,
a varios isómeros, como por ejemplo:
CH2=CH–CH=CH2:
1,3–butadieno
CHºC–CH2–CH3:
1–butino
Fórmulas
que corresponden a distintos isómeros de función,
pues ambos compuestos pertenecen a diferentes funciones orgánicas:
alquenos y alquinos.
No son los únicos isómeros que pueden encontrarse;
con la misma fórmula C4H6 podríamos
encontrar el 1,2–butadieno, el cliclobuteno o el 2–butino.
|
| Respuesta
9 |
a)
Si se está hablando de un hidrocarburo lineal de fórmula
C4H2, la única posibilidad es que el
compuesto A sea el 1,3–butadiino ( HCºC–CºCH).
Si ese
compuesto adiciona H2 para transformarse en B
(C4H6), la reacción que habrá
tenido lugar es:
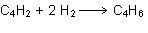
por tanto,
la cantidad de hidrógeno adicionado dependerá de
los moles de A de que disponíamos:
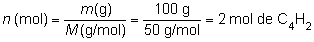
Analizando
las relaciones estequiométricas entre el C4H2
y el H2:
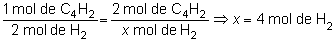
y para expresar
ese resultado en forma de volumen recurrimos a la ecuación
de los gases ideales:
pV
= nRT
donde:

b)
Cabe esperar que en el compuesto B hayan aparecido dos
dobles enlaces. Por tanto, se precisarían 2 moles de HBr
para adicionarse a cada uno de esos dos dobles enlaces, según
una reacción genérica:
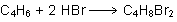
c)
La reacción más lógica que habrá
tenido lugar en el apartado a) es:

porque teóricamente
también podría haberse dado esta otra:
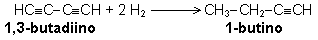
Sin embargo,
en el propio enunciado se comenta que el compuesto B presenta
dobles enlaces, luego se están refiriendo a la primera
reacción. Para
el apartado b), la adición de HBr a los dobles
enlaces, sí debe hablarse de una mezcla de isómeros
de posición:

aunque mayoritario
fuera el último, según la regla de Markonikov que
rige los procesos de adición a alquenos (el hidrógeno
del HBr se adiciona al átomo de carbono del doble enlace
que más hidrógenos posea).
|
| Respuesta
10 |
| a)
Combustión de un hidrocarburo:
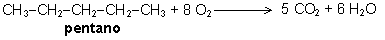
La combustión
de un hidrocarburo es una reacción de oxidación
total de la molécula.
b)
Hidrogenación de un alqueno:

La hidrogenación
de un alqueno puede considerarse como una reacción de adición
de hidrógeno al doble enlace.
c)
Oxidación de un alcohol:
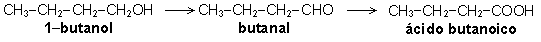
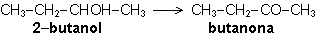
La oxidación
de un alcohol es un proceso que en primer lugar lleva a la formación
de grupos carbonilos en la molécula (aldehídos o
cetonas). Por eso recogemos un ejemplo de cada reacción,
pudiendo en el primer caso proseguir la oxidación hasta
la formación de un ácido, por encontrarse el grupo
alcohol en un carbono terminal donde se formará el grupo
carboxilo, lo que es imposible que ocurra a partir de una cetona.
d) La reacción de esterificación
se produce entre un alcohol y un ácido orgánico,
produciéndose como consecuencia un éster y desprendiéndose
agua.
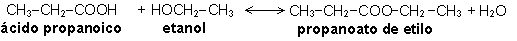
|
|